Rizmoic
COMPOSE-4-studien av naldemedin för OIC hos cancerpatienter
COMPOSE-4-studien var specifikt utformad för att utvärdera effekt och säkerhet för naldemedin, en perifert verkande μ-opioidreceptorantagonist, i syfte att lindra OIC hos denna patientpopulation.
Studiens utformning
Huvudsyftet med COMPOSE-4 var att påvisa effekten av naldemedin jämfört med placebo vid behandling av OIC hos vuxna med cancersmärta efter 14 dagars behandling. COMPOSE-4 var en dubbelblind, randomiserad fas 3-multicenterstudie med parallella grupper som genomfördes under två veckor. I studien deltog 193 cancerpatienter som stod på en stabil daglig dos av opioider och upplevde signifikant förstoppning till följd av detta. Deltagarna randomiserades i förhållandet 1:1 till att få antingen 0,2 mg naldemedin eller placebo en gång per dag.
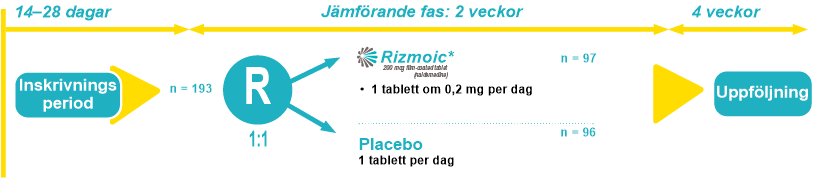
Inklusionskriterierna var inriktade på vuxna cancerpatienter i åldern 20 år och äldre som hade fått en stabil dos av opioider i minst två veckor före randomisering. Dessa patienter hade haft fem eller färre spontana tarmtömningar under 14 dagar före randomisering, med signifikanta förstoppningssymtom som krystning, ofullständig tarmtömning eller hård avföring.
Ett krav var att patienterna skulle fortsätta med sin vanliga laxerande behandling utan några förändringar under hela screening- och behandlingsfasen. Om en biverkning som exempelvis diarré väsentligt påverkade patientens livskvalitet kunde dock prövaren tillåta ett tillfälligt stopp eller dosminskning av laxermedlet. Vidare tilläts patienterna att använda akutlaxermedel vid behov, med undantag för 24 timmar före och efter administrering av den initiala dosen av studieläkemedlet.

Effektresultat
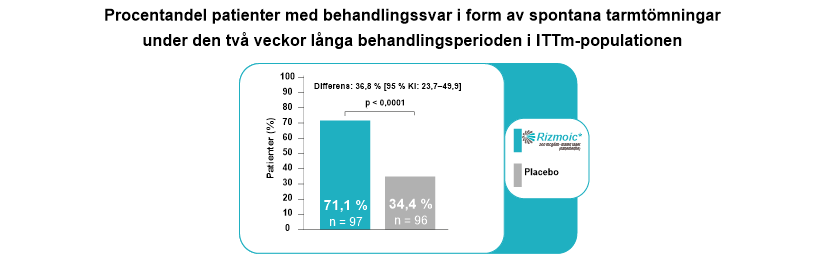
Det primära effektmåttet för studien var andelen patienter som uppnådde ≥ 3 spontana tarmtömningar (SBM) per vecka med en ökning med minst 1 SBM per vecka jämfört med baslinjen. Med detta mått kunde man direkt utvärdera effekten av naldemedin när det gällde att förbättra tarmfunktionen under behandlingsperioden.
Man såg en signifikant skillnad mellan naldemedin- och placebogrupperna i andelen patienter med behandlingssvar ifråga om SBM. Cirka 71,1 % av patienterna i naldemedingruppen uppnådde det primära effektmåttet jämfört med endast 34,4 % i placebogruppen, med ett p-värde på < 0,0001.
Säkerhet och tolerabilitet
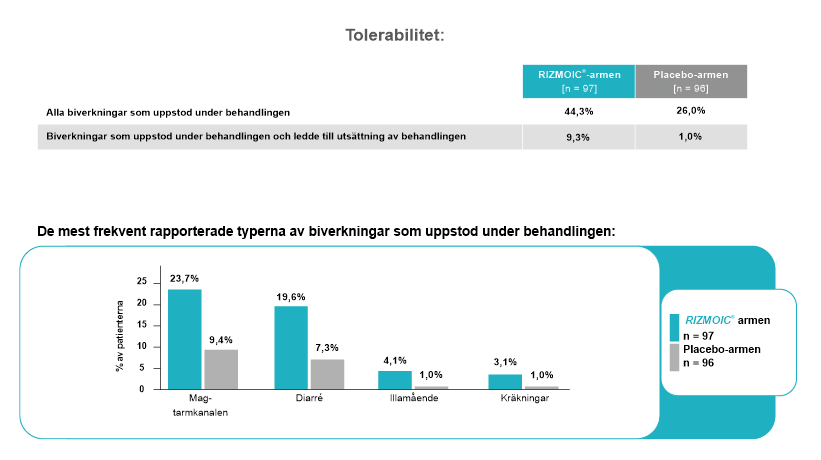
Säkerhet var en kritisk komponent i studien, med hänsyn till patientpopulationens sårbara tillstånd. Säkerhetsutvärderingarna fokuserade på frekvensen av biverkningar, särskilt störningar i mag-tarmkanalen, som var de mest relevanta för behandlingen.
- Total incidens: Biverkningar rapporterades hos 44,3 % av patienterna i naldemedingruppen jämfört med 26 % i placebogruppen. Den högre incidensen i naldemedingruppen var förväntad på grund av läkemedlets farmakologiska verkan på mag-tarmkanalen.
- Utsättning på grund av biverkningar: En liten andel av patienterna avbröt behandlingen på grund av biverkningar: 9,3 % i naldemedingruppen och 1 % i placebogruppen. Detta visar på att behandlingen generellt var väl tolererad, trots den högre incidensen av biverkningar.
Kliniska konsekvenser
COMPOSE-4-studien visade att naldemedin förbättrar tarmfunktionen hos cancerpatienter som besväras av OIC. Den betydande skillnaden i behandlingssvarsfrekvens mellan naldemedin- och placebogruppen visar att naldemedin har potential att ge signifikant lindring av förstoppning.
För onkologer och personal inom den palliativa vården visar resultaten från COMPOSE-4 att naldemedin är ett terapeutiskt alternativ för att behandla OIC hos cancerpatienter. Naldemedin kan ge lindring av OIC, vilket i sin tur kan hjälpa patienter att fortsätta med sin ordinerade opioidregim på ett effektivt sätt.
Se produktresumén för mer information om mindre vanliga eller sällsynta biverkningar.
Rapportera omedelbart alla misstänkta biverkningar till PV.Sweden@viatris.com och Läkemedelsverket
Referenser:
- Katakami N, Harada T, Murata T et al. Randomized phase III and extension studies of naldemedine in patients with opioid-induced constipation and cancer. J Clin Oncol 2017;35(34):3859–3866
Rizmoic (naldemedin), 200µg, filmdragerade tabletter. ATC-kod: A06AH05. Rx.
(F).
Indikation: Opioidorsakad förstoppning hos vuxna patienter som tidigare har behandlats med laxermedel.
Kontraindikationer: Patienter med känd eller misstänkt gastrointestinal obstruktion eller perforation eller
patienter med ökad risk för återkommande obstruktion, till följd av risken för gastrointestinal perforation.
Förpackningar: 30 och 100 tabletter. Produktresumé senast uppdaterad: 07-2024. Begränsningar:
Subventioneras endast för patienter med otillräckligt behandlingssvar på laxermedel. För patienter som behandlas med
oxikodon gäller subvention endast då kombinationsläkemedel innehållande oxikodon och naloxon har otillräcklig effekt
eller inte är lämpligt. För ytterligare information och pris se www.fass.se. Innehavare av godkännande för
försäljning: Shionogi B.V. Marknadsförs lokalt av Viatris AB. Tel: 08-630 19 00.
Adress: Viatris AB, Tel: 08-630 19 00
Kod: SE-RIZM-2024-00028 Okt


