Rizmoic
Säkerhetsinformation
Kontraindikationer
- Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i detta avsnitt.
- Patienter med känd eller misstänkt gastrointestinal obstruktion eller perforation eller patienter med ökad risk för återkommande obstruktion, till följd av risken för gastrointestinal perforation.
Varningar och försiktighet
Gastrointestinal perforation
Fall med gastrointestinal perforation har rapporterats efter godkännandet för försäljning (se avsnittet
Biverkningar), inklusive dödsfall, när naldemedin gavs till patienter som löpte ökad risk för gastrointestinal
perforation (t.ex. divertikelsjukdom och underliggande maligniteter i magtarmkanalen eller peritoneal
metastasering).
Naldemedin får inte användas till patienter med känd eller misstänkt gastrointestinal obstruktion eller till patienter med ökad risk för återkommande obstruktion, till följd av risken för gastrointestinal perforation (se avsnittet Kontraindikationer).
Försiktighet avseende användningen av naldemedin ska iakttas hos patienter med tillstånd som kan resultera i försämrad integritet av magtarmkanalens vägg (t.ex. peptiskt sår, Ogilvies syndrom [pseudoobstruktion av kolon], malignitet i magtarmkanalen och Crohns sjukdom). Det totala nytta–risk-förhållandet ska beaktas för varje patient. Patienterna ska övervakas för utveckling av svår, ihållande eller förvärrad buksmärta. Om obstruktion eller perforation misstänks, måste naldemedinbehandlingen sättas ut.
Gastrointestinala biverkningar
Bukrelaterade biverkningar (t.ex. buksmärta, kräkningar och diarré) har rapporterats vid användning av Rizmoic.
Patienterna ska uppmanas att rapportera svåra, ihållande eller förvärrade symtom till sin läkare. Vid fall med
diarré eller buksmärta ska patienten övervakas och behandlas för dehydrering med hjälp av rehydrering och lämplig
behandling vid behov (se avsnittet Biverkningar).
Opioidabstinenssyndrom
Opioidabstinenssyndrom är en kombination av tre eller flera av följande tecken eller symtom: dysforiskt
stämningsläge, illamående eller kräkningar, muskelsmärta, tårproduktion eller rinorré, dilaterade pupiller,
piloerektion eller svettningar, diarré, gäspning, feber eller insomni. Opioidabstinenssyndrom utvecklas vanligtvis
inom minuter till flera dagar efter administrering av en opioidantagonist. Försiktighet ska iakttas avseende
opioidabstinens. Patienterna ska uppmanas att avbryta naldemedin och kontakta sin läkare om opioidabstinens uppstår.
Fall med möjliga opioidabstinenssyndrom har rapporterats i det kliniska programmet med naldemedin (se avsnittet
Biverkningar).
Patienter med skador på blod-hjärnbarriären (t.ex. primära hjärnmaligniteter, metastaser i centrala nervsystemet (CNS) eller andra inflammatoriska tillstånd, aktiv multipel skleros och avancerad Alzheimers sjukdom) kan löpa högre risk för opioidabstinens eller reducerad smärtlindring. Det totala nytta–risk-förhållandet för naldemedin ska övervägas hos dessa patienter med noggrann övervakning för symtom på opioidabstinens.
Patienter med kardiovaskulära tillstånd
Naldemedin har inte studerats i det kliniska prövningsprogrammet hos patienter med anamnes på nyligen genomgången
hjärtinfarkt, stroke eller transitorisk ischemisk attack inom 3 månader före screening. Dessa patienter ska
kontrolleras kliniskt när de tar Rizmoic.
En studie av QTc som utfördes med naldemedin på friska frivilliga försökspersoner tydde inte på någon förlängning av QT-intervallet. Patienter med riskfaktorer för kardiovaskulär sjukdom uteslöts inte från det kliniska prövningsprogrammet med naldemedin, där BMI ≥ 30 kg/m2 och en medicinsk anamnes på hypertoni och/eller dyslipidemi var de vanligast rapporterade riskfaktorerna.
Svårt nedsatt njurfunktion
På grund av begränsad terapeutisk erfarenhet hos patienter med svårt nedsatt njurfunktion ska dessa patienter
övervakas kliniskt när behandling med naldemedin inleds.
Patienter med svårt nedsatt leverfunktion
Naldemedin har inte studerats hos patienter med svårt nedsatt leverfunktion. Användning av naldemedin rekommenderas
inte till dessa patienter.
Opioida smärtstillande läkemedel
Erfarenheten är begränsad hos patienter som behandlas med opioida smärtstillande läkemedel vid dagliga doser som
överstiger motsvarande 400 mg morfin. Erfarenhet hos patienter som behandlas för förstoppning som framkallats av
partiella opioida mu agonister (t.ex. buprenorfin) saknas. Försiktighet bör iakttas vid behandling av dessa
patienter.
Samtidig användning av starka CYP3A-hämmare och -inducerare
Samtidig användning av naldemedin och starka CYP3A-hämmare (t.ex. grapefruktjuice, itrakonazol, ketokonazol,
ritonavir, indinavir, sakvinavir, telitromycin och klaritromycin) leder till en ökad exponering av naldemedin och
kan öka risken för biverkningar. Samtidig användning av starka CYP3A-hämmare ska undvikas. Samtidig användning av
naldemedin och starka CYP3A-inducerare (t.ex. johannesört (Hypericum perforatum), rifampicin, karbamazepin,
fenobarbital och fenytoin) leder till en minskad exponering av naldemedin och kan sänka effekten av naldemedin.
Samtidig användning av starka CYP3A-inducerare rekommenderas inte. Samtidig användning av naldemedin och måttliga
CYP3A inducerare (t.ex. efavirenz) har inte fastställts och ska användas med försiktighet.
Natrium
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per tablett, d.v.s. är näst intill ”natriumfritt”.
Fertilitet, graviditet och amning
Graviditet
Det finns inga data från användningen av naldemedin hos gravida kvinnor. Djurstudier visar inga direkta eller
indirekta skadliga reproduktionstoxikologiska effekter. Användning av naldemedin under graviditet kan framkalla
opioidabstinens hos fostret till följd av den outvecklade blod-hjärnbarriären hos fostret. Naldemedin ska användas
under graviditet endast då tillståndet kräver att det är absolut nödvändigt att kvinnan behandlas med naldemedin.
Amning
Det är okänt om naldemedin/metaboliter utsöndras i bröstmjölk. Tillgängliga data från råttor har visat att
naldemedin utsöndras i mjölk. Vid terapeutiska doser utsöndras de flesta opioider (t.ex. morfin, meperidin och
metadon) i bröstmjölk i minimala mängder. Det finns en teoretisk möjlighet att naldemedin utlöser opioidabstinens
hos en ammad nyfödd vars moder tar en opioidreceptorantagonist. En risk för det ammade barnet kan inte uteslutas.
Naldemedin ska inte användas under amning.
Fertilitet
Det finns inga tillgängliga data om effekten av naldemedin på fertilitet hos människa. Naldemedin befanns inte ha
några kliniskt relevanta biverkningar på fertilitet eller reproduktionsförmåga hos han- eller honråttor.
Biverkningar
Sammanfattning av säkerhetsprofilen
De vanligast rapporterade biverkningarna hos patienter med kronisk icke-cancersmärta och OIC var buksmärta (7,8 %),
diarré (5,9 %), illamående (3,6 %) och kräkningar (1,1 %). De flesta av dessa gastrointestinala biverkningar var av
lindrig till måttlig svårighetsgrad och försvann utan avbrott med naldemedinbehandlingen. Ett allvarligt fall med
buksmärta och ett allvarligt fall med illamående rapporterades hos patienter med kronisk icke-cancersmärta och OIC.
De vanligast rapporterade biverkningarna hos patienter med cancer och OIC var diarré (24,5 %) och buksmärta (3,9 %). De flesta av dessa gastrointestinala biverkningar var av lindrig till måttlig svårighetsgrad och försvann med behandling. Två allvarliga fall med diarré rapporterades hos patienter med cancer och OIC.
Lista över biverkningar i tabellform
Biverkningarna med naldemedin 200 mikrogram tabletter hos patienter med kronisk icke-cancersmärta och OIC och hos
patienter med cancer och OIC, som rapporterades i kliniska studier, presenteras i tabellerna enligt
MedDRA-klassificeringen av organsystem. Frekvenskategorierna definieras med användning av följande konvention:
mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, <
1/1 000), mycket sällsynta (< 1/10 000) och ingen känd frekvens (frekvensen kan inte beräknas från tillgängliga
data). Inom varje frekvensgruppering presenteras biverkningar efter minskad svårighetsgrad.
Biverkningarna presenteras genom klassificering av organsystem och frekvens hos patienter med kronisk icke-cancersmärta och opioidframkallad förstoppning.

*Av MedDRA föredragna termer: buksmärta, smärta i övre delen av buken, smärta i nedre delen av buken och obehagskänsla i buken.
Biverkningarna presenteras genom klassificering av organsystem och frekvens hos patienter med cancer och opioidframkallad förstoppning.
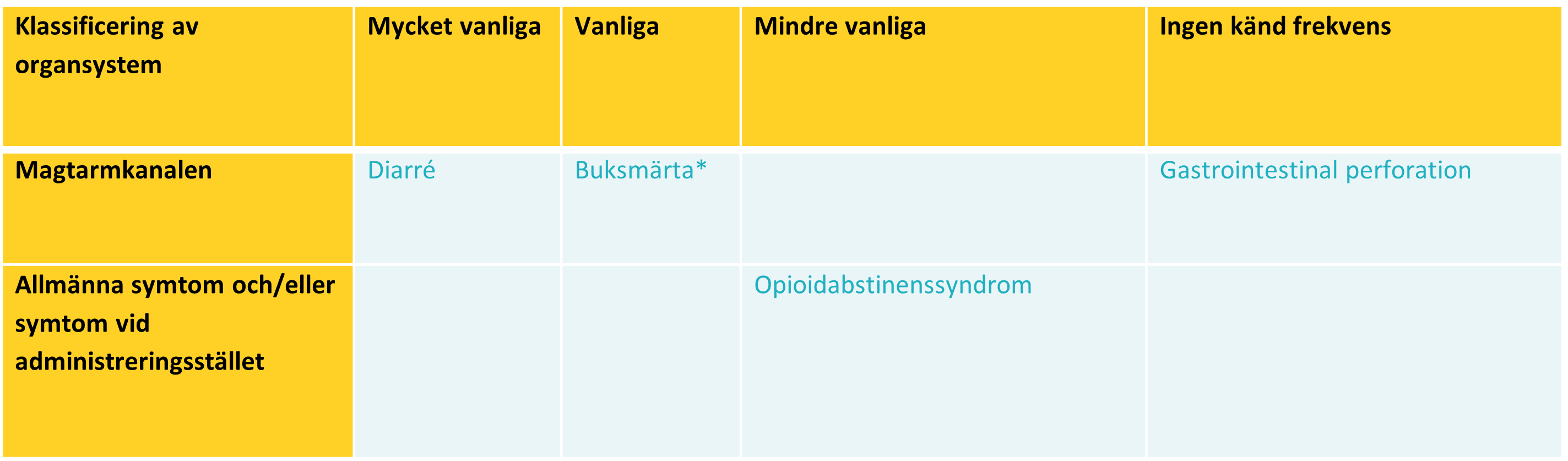
*Av MedDRA föredragna termer: buksmärta, smärta i övre delen av buken, smärta i nedre delen av buken och obehagskänsla i buken.
Beskrivning av utvalda biverkningar
Opioidabstinenssyndrom:
Möjlig opioidabstinens, som definieras som minst tre biverkningar potentiellt relaterade till
opioidabstinens som förekom samma dag och som inte var enbart relaterade till magtarmkanalen, förekom hos
0,8 % (9/1 163) av patienterna med kronisk icke-cancersmärta och OIC som tog naldemedin jämfört med 0,2 %
(2/1 165) av patienterna som tog placebo oavsett underhållsbehandling med opioider, och 0,6 % (1/155) av
patienterna med cancer och OIC som tog naldemedin 200 mikrogram jämfört med 0 % (0/152) som tog placebo.
Symtomen inkluderade, men var inte begränsade till, hyperhidros, frossa, ökad tårproduktion,
värmevallning/rodnad, feber, nysningar, köldkänsla, buksmärta, diarré, illamående, kräkningar, artralgi,
myalgi och takykardi.
Magtarmkanalen:
Buksmärta, diarré, illamående och kräkningar var de vanligast rapporterade biverkningarna i kliniska studier
på patienter med kronisk icke-cancersmärta och OIC och patienter med cancer och OIC. De flesta av dessa
gastrointestinala biverkningar var av lindrig till måttlig svårighetsgrad och försvann med behandling.
Utsättningsfrekvensen till följd av gastrointestinala biverkningar som utlösts av behandling med naldemedin
200 mikrogram jämfört med placebo var 3,2 % respektive 1 % hos patienter med kronisk icke-cancersmärta och
OIC samt 4,5 % respektive 0 % för patienter med cancer och OIC.
Överdosering
Friska frivilliga försökspersoner
En enkeldos med naldemedin på upp till 100 mg och flera doser på upp till 30 mg/dag under 10 dagar
administrerades till friska frivilliga försökspersoner i kliniska studier. Dosberoende ökningar av
gastrointestinala biverkningar, inklusive buksmärta, diarré och illamående observerades. Dessa var av
lindrig eller måttlig svårighetsgrad och försvann.
Patienter med OIC
En enkeldos med naldemedin (0,01–3 mg) och flera doser på 0,4 mg/dag administrerades till patienter med OIC
i kliniska studier. En patient som tog en enkeldos naldemedin 1 mg fick allvarligt opioidabstinenssyndrom,
inklusive illamående och magkramper och fick esomeprazol och ondansetron för illamående och
midazolamhydroklorid för magkramper. Symtomen försvann. I kliniska studier hade patienter med OIC som
administrerades 0,4 mg/dag (två gånger den rekommenderade dosen) under 4 veckor en ökad förekomst av
gastrointestinala läkemedelsbiverkningar, inklusive diarré och buksmärta frekvent inom 1–2 dagar efter
startdos.
Behandling
Det finns ingen specifik antidot för naldemedin. Naldemedin avlägsnas inte från kroppen genom hemodialys. I
händelse av en överdos ska patienten övervakas noga för potentiella tecken och symtom på
opioidabstinenssyndrom och ges lämplig understödjande vård.
Se produktresumén för mer information om mindre vanliga eller sällsynta biverkningar.
Rapportera omedelbart alla misstänkta biverkningar till PV.Sweden@viatris.com och Läkemedelsverket.
Referenser:
- RIZMOIC SPC. https://www.fass.se/LIF/product?userType=0&nplId=20170302000160 Hämtad den 6 juni 2024
Rizmoic (naldemedin), 200µg, filmdragerade tabletter. ATC-kod: A06AH05. Rx. (F).
Indikation: Opioidorsakad förstoppning hos vuxna patienter som tidigare har behandlats med laxermedel. Kontraindikationer: Patienter med känd eller misstänkt gastrointestinal obstruktion eller perforation eller patienter med ökad risk för återkommande obstruktion, till följd av risken för gastrointestinal perforation. Förpackningar: 30 och 100 tabletter. Produktresumé senast uppdaterad: 07-2024. Begränsningar: Subventioneras endast för patienter med otillräckligt behandlingssvar på laxermedel. För patienter som behandlas med oxikodon gäller subvention endast då kombinationsläkemedel innehållande oxikodon och naloxon har otillräcklig effekt eller inte är lämpligt. För ytterligare information och pris se www.fass.se. Innehavare av godkännande för försäljning: Shionogi B.V. Marknadsförs lokalt av Viatris AB. Tel: 08-630 19 00.
Adress: Viatris AB, Tel: 08-630 19 00
Kod: SE-RIZM-2024-00028 Okt


