Rizmoic
COMPOSE-3: studie av långsiktig effekt och säkerhet för naldemedin vid OIC
Opioidinducerad förstoppning (OIC) är en utbredd och mycket besvärlig biverkning hos patienter som genomgår långvarig opioidbehandling. COMPOSE-3-studien1 var utformad för att bedöma långsiktig effekt och säkerhet för naldemedin, en perifert verkande μ-opioidreceptorantagonist, under en 52-veckorsperiod. Studien gav viktiga insikter i användningen av naldemedin i klinisk praxis.
Studiens utformning
Det primära målet med COMPOSE-3 var att utvärdera långsiktig effekt och säkerhet för naldemedin hos vuxna med kronisk icke-cancersmärta som fått en stabil opioiddos i över en månad och hade opioidinducerad förstoppning. Studien syftade till att fastställa om naldemedin kan administreras säkert under en längre period utan att dess effekt minskar eller den primära analgetiska behandlingen påverkas.
COMPOSE-3 var en dubbelblind, randomiserad fas 3-multicenterstudie med parallella grupper där 1 246 deltagare ingick. Deltagarna randomiserades i förhållandet 1:1 till att få antingen 0,2 mg naldemedin eller placebo oralt gång per dag i 52 veckor efter en screeningfas på 14–28 dagar. Randomiseringen stratifierades i två kategorier utifrån den genomsnittliga totala dagliga opioiddosen under den 14 dagar långa bedömningsfasen: 30–100 mg respektive mer än 100 mg orala morfinsulfatekvivalenter.
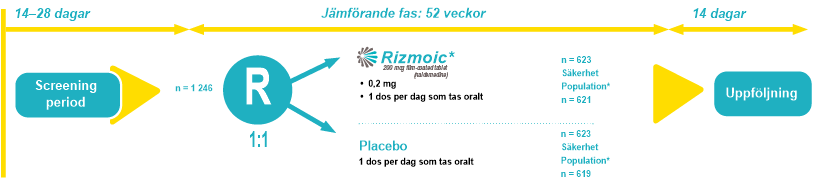
Deltagarnas ålder varierade från 18 till 80 år. Samtliga hade kronisk icke-cancersmärta och stod på stabil opioidanvändning. Stratifieringen baserades på total genomsnittlig daglig dos av opioider under en bedömningsperiod på 14 dagar i följd. Mångfalden inom populationen gav en bred grund för att utvärdera effekterna av naldemedin över olika demografiska grupper. Inklusionskriterierna säkerställde att samtliga deltagare hade haft färre än fyra spontana tarmtömningar per vecka under bedömningsperioden, vilket indikerar måttlig till svår OIC.

Resultat
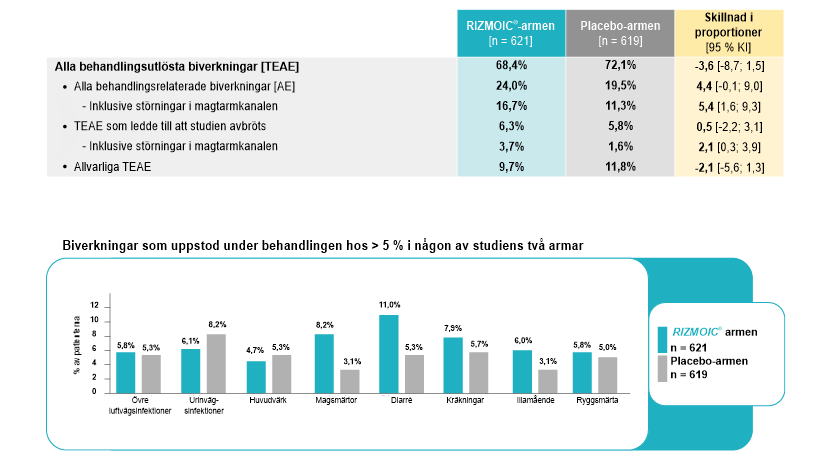
Det primära effektmåttet var frekvensen av biverkningar, inklusive incidensen av behandlingsutlösta biverkningar (TEAE), allvarliga biverkningar och biverkningar som ledde till utsättning av behandlingen. Resultaten av denna studie var avgörande för att förstå den långsiktiga tolerabiliteten för naldemedin.
- Säkerhet och tolerabilitet: Naldemedin uppvisade en säkerhetsprofil som överensstämmer med tidigare korttidsstudier. TEAE rapporterades hos 68,4 % i naldemedingruppen jämfört med 72,1 % i placebogruppen (skillnad i andel: 23,6 %; 95 % konfidensintervall: 28,7 till 1,5) utan någon signifikant ökning av biverkningarna på grund av långtidsbehandling.
- Utsättning av behandlingen: Förekomsten av TEAE som ledde till utsättning var något högre i naldemedingruppen (6,3 %) jämfört med placebogruppen (5,8 %) vilket indikerar att naldemedin generellt tolererades väl.
- Mag-tarmkanalen: Som förväntat med ett läkemedel som riktas mot opioidreceptorerna i tarmen var störningar i mag-tarmkanalen de vanligast rapporterade biverkningarna. Dessa biverkningar ledde dock inte till någon betydande ökning av utsättningsfrekvensen, vilket tyder på att de var hanterbara i det aktuella kliniska sammanhanget.
Kliniska konsekvenser
Resultaten från COMPOSE-3 ger evidens som stöder långvarig användning av naldemedin som behandling av OIC hos patienter med kronisk icke-cancersmärta. Viktigt att notera är att studien bekräftade att naldemedin inte stör den CNS-medierade analgetiska effekten och inte heller påskyndar opioidabstinens, vilket erbjuder en lösning på två kritiska problem i behandlingen av OIC.
Se produktresumén för mer information om mindre vanliga eller sällsynta biverkningar.
Rapportera omedelbart alla misstänkta biverkningar till PV.Sweden@viatris.com och Läkemedelsverket
Referenser:
- Webster LR, Nalamachu S, Morlion B, et al. Long-term use of naldemedine in the treatment of OIC in patients with chronic noncancer pain: a randomized, double-blind, placebo-controlled phase 3 study. Pain. Maj 2018;159(5):987–994
Rizmoic (naldemedin), 200µg, filmdragerade tabletter. ATC-kod: A06AH05. Rx.
(F).
Indikation: Opioidorsakad förstoppning hos vuxna patienter som tidigare har behandlats med laxermedel.
Kontraindikationer: Patienter med känd eller misstänkt gastrointestinal obstruktion eller perforation eller
patienter med ökad risk för återkommande obstruktion, till följd av risken för gastrointestinal perforation.
Förpackningar: 30 och 100 tabletter. Produktresumé senast uppdaterad: 07-2024. Begränsningar:
Subventioneras endast för patienter med otillräckligt behandlingssvar på laxermedel. För patienter som behandlas med
oxikodon gäller subvention endast då kombinationsläkemedel innehållande oxikodon och naloxon har otillräcklig effekt
eller inte är lämpligt. För ytterligare information och pris se www.fass.se. Innehavare av godkännande för
försäljning: Shionogi B.V. Marknadsförs lokalt av Viatris AB. Tel: 08-630 19 00.
Adress: Viatris AB, Tel: 08-630 19 00
Kod: SE-RIZM-2024-00028 Okt


